Οι χημικοί ονειρευόντουσαν από καιρό να κατανοήσουν πλήρως και να κατακτήσουν κάθε γνώση για τα χημικά εργαλεία της ζωής, τις πρωτεΐνες. Αυτό το όνειρο είναι πλέον εφικτό. Οι Demis Hassabis και John Jumper, με τη βοήθεια της τεχνητής νοημοσύνης έλυσαν με επιτυχία ένα πρόβλημα με το οποίο οι χημικοί πάλευαν για περισσότερα από 50 χρόνια: την πρόβλεψη της τρισδιάστατης δομής μιας πρωτεΐνης από μια αλληλουχία αμινοξέων.
Αυτό τους επέτρεψε να προβλέψουν τη δομή σχεδόν και των 200 εκατομμυρίων γνωστών πρωτεϊνών. Το άλλο μισό του βραβείου Νόμπελ Χημείας απονέμεται στον David Baker, ο οποίος ανέπτυξε μεθόδους για να επιτύχει αυτό που πολλοί άνθρωποι πίστευαν ότι ήταν αδύνατο: την δημιουργία πρωτεϊνών που δεν υπήρχαν προηγουμένως και οι οποίες, σε πολλές περιπτώσεις, έχουν εντελώς νέες λειτουργίες.
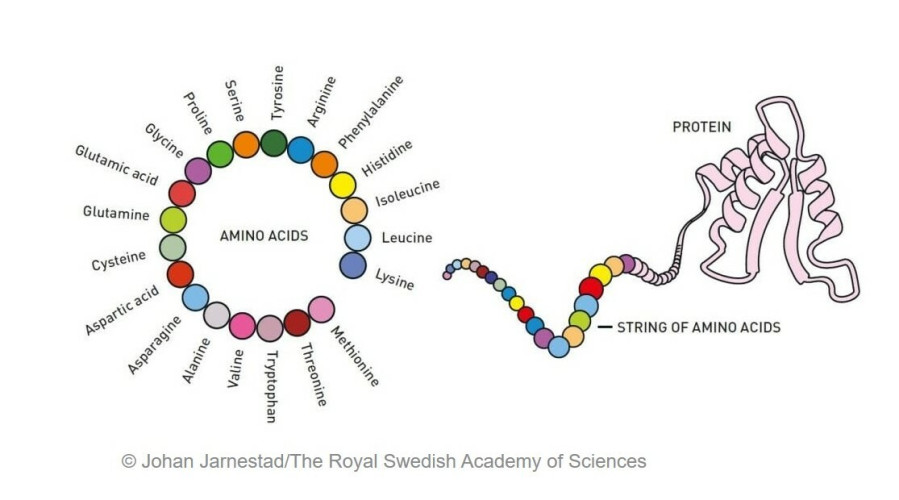
Η ποικιλομορφία της ζωής μαρτυρεί την εκπληκτική λειτουργικότητα των πρωτεϊνών ως χημικών εργαλείων. Ελέγχουν και καθοδηγούν όλες τις χημικές αντιδράσεις που μαζί αποτελούν τη βάση της ζωής. Οι πρωτεΐνες λειτουργούν επίσης ως ορμόνες, ως ουσίες σηματοδότησης, ως αντισώματα και ως δομικά στοιχεία διαφορετικών ιστών.
Οι πρωτεΐνες αποτελούνται γενικά από 20 διαφορετικά αμινοξέα, τα οποία μπορούν να περιγραφούν ως δομικά στοιχεία της ζωής. Το 2003, ο David Baker πέτυχε να χρησιμοποιήσει αυτά τα μπλοκ για να σχεδιάσει μια νέα πρωτεΐνη που δεν έμοιαζε με καμία άλλη. Από τότε, η ερευνητική του ομάδα έχει δημιουργήσει ευφάνταστα τη μια πρωτεΐνη μετά την άλλη, συμπεριλαμβανομένων πρωτεϊνών που μπορούν να χρησιμοποιηθούν ως φαρμακευτικά προϊόντα, ως εμβόλια, ως νανοϋλικά και ως μικροσκοπικοί αισθητήρες.
Η δεύτερη ανακάλυψη αφορά την πρόβλεψη των πρωτεϊνικών δομών. Στις πρωτεΐνες, τα αμινοξέα συνδέονται μεταξύ τους σχηματίζοντας μακριές ‘χορδές’ που διπλώνουν για να δημιουργήσουν μια τρισδιάστατη δομή, η οποία είναι καθοριστική για τη λειτουργία της πρωτεΐνης. Από τη δεκαετία του 1970, οι ερευνητές είχαν προσπαθήσει να προβλέψουν μέσα από τις αλληλουχίες των αμινοξέων τις πρωτεϊνικές δομές, αλλά αυτό ήταν εμφανώς δύσκολο. Ωστόσο, πριν από τέσσερα χρόνια, υπήρξε μια εκπληκτική ανακάλυψη.
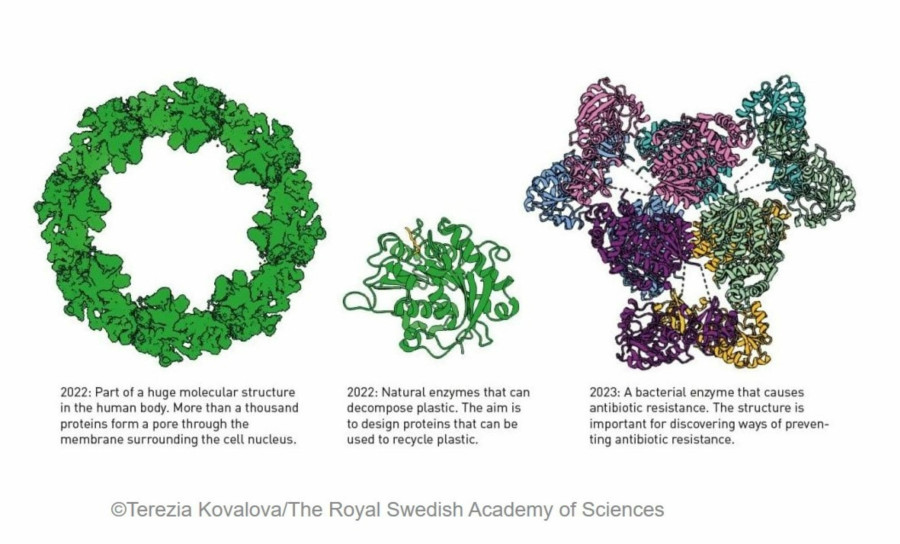
Το 2020, ο Demis Hassabis και ο John Jumper παρουσίασαν ένα μοντέλο AI που ονομάζεται AlphaFold2. Με τη βοήθειά του, μπόρεσαν να προβλέψουν την δομή σχεδόν και των 200 εκατομμυρίων πρωτεϊνών που έχουν εντοπίσει οι ερευνητές. Από την ανακάλυψή τους, το AlphaFold2 έχει χρησιμοποιηθεί από περισσότερα από δύο εκατομμύρια άτομα από 190 χώρες. Μεταξύ μιας μυριάδας επιστημονικών εφαρμογών, οι ερευνητές μπορούν τώρα να κατανοήσουν καλύτερα την αντοχή στα αντιβιοτικά και να δημιουργήσουν εικόνες ενζύμων που μπορούν να αποσυνθέσουν το πλαστικό.
Η ζωή δεν θα μπορούσε να υπάρξει χωρίς πρωτεΐνες. Το ότι μπορούμε τώρα να προβλέψουμε τις πρωτεϊνικές δομές και να σχεδιάσουμε τις δικές μας πρωτεΐνες προσφέρει το μεγαλύτερο όφελος στην ανθρωπότητα.
Μια γρήγορη ματιά στο παρελθόν του Ντέμη Χασάμπη
Άρχισε να παίζει σκάκι σε ηλικία τεσσάρων ετών και πέτυχε το master level ως 13χρονος. Στην εφηβεία του ξεκίνησε μια καριέρα ως προγραμματιστής και ως game developer. Άρχισε να εξερευνά την τεχνητή νοημοσύνη και ασχολήθηκε με τη νευροεπιστήμη. Χρησιμοποίησε όσα έμαθε για τον εγκέφαλο για να αναπτύξει καλύτερα νευρωνικά δίκτυα και το 2010 ίδρυσε την DeepMind, μια εταιρεία που ανέπτυξε αριστουργηματικά μοντέλα AI για δημοφιλή επιτραπέζια παιχνίδια. Η εταιρεία πουλήθηκε στην Google το 2014 και, δύο χρόνια αργότερα, η DeepMind κέρδισε την προσοχή παγκοσμίως όταν πέτυχε αυτό που πολλοί τότε πίστευαν ότι ήταν το ιερό δισκοπότηρο της τεχνητής νοημοσύνης: νίκησε τον πρωταθλητή παίκτη ενός από τα παλαιότερα επιτραπέζια παιχνίδια στον κόσμο, του Go.
Ωστόσο, για τον Hassabis, το Go δεν ήταν ο στόχος, ήταν το μέσο για την ανάπτυξη καλύτερων μοντέλων AI. Μετά από αυτή τη νίκη, η ομάδα του ήταν έτοιμη να αντιμετωπίσει προκλήσεις μεγαλύτερης σημασίας για την ανθρωπότητα, έτσι το 2018 έλαβε μέρος στον 13ο διαγωνισμό CASP Critical Assessment of Structure Prediction ( CASP), που είναι ένα παγκόσμιο πείραμα για την πρόβλεψη τη πρωτεϊνικής δομής, το οποίο λαμβάνει χώρα κάθε δύο χρόνια από το 1994.
Τα προηγούμενα χρόνια, οι δομές πρωτεΐνης που προέβλεπαν οι ερευνητές στον CASP είχαν επιτύχει ακρίβεια 40%, στην καλύτερη περίπτωση. Με το μοντέλο AI, που ονομαζόταν AlphaFold, η ομάδα του Hassabis έφτασε σχεδόν το 60% και τελικά κέρδισε, ξαφνιάζοντας πολλούς. Ήταν απροσδόκητη πρόοδος, αλλά το μοντέλο δεν ήταν ακόμα αρκετά καλό, καθώς θα έπρεπε να έχει ακρίβεια 90%.
Ο Hassabis και η ομάδα του συνέχισαν να αναπτύσσουν το AlphaFold, αλλά, όσο σκληρά και αν προσπάθησαν, ο αλγόριθμος δεν πήγε ποτέ μέχρι το τέλος. Η σκληρή αλήθεια ήταν ότι είχαν φτάσει σε αδιέξοδο. Η ομάδα ήταν κουρασμένη, αλλά ένας σχετικά νέος συνεργάτης είχε έξυπνες ιδέες για το πώς θα μπορούσε να βελτιωθεί το μοντέλο AI. Αυτός ήταν ο John Jumper.
Ο John Jumper αναλαμβάνει τα ηνία της μεγάλης πρόκλησης
Η γοητεία που ασκούσε το Σύμπαν στον John Jumper ήταν η αιτία να σπουδάσει φυσική και μαθηματικά. Ωστόσο, το 2008, όταν άρχισε να εργάζεται σε μια εταιρεία που χρησιμοποιούσε υπερυπολογιστές για την προσομοίωση πρωτεϊνών, συνειδητοποίησε ότι η γνώση της φυσικής θα μπορούσε να βοηθήσει στην επίλυση ιατρικών προβλημάτων.
Ο Τζάμπερ πήρε μαζί του αυτό το ενδιαφέρον που απέκτησε για τις πρωτεΐνες όταν, το 2011, ξεκίνησε το διδακτορικό του στη θεωρητική φυσική. Για να εξοικονομήσει χώρο στον υπολογιστή -κάτι που δεν υπήρχε στο πανεπιστήμιο- άρχισε να αναπτύσσει απλούστερες και πιο έξυπνες μεθόδους για την προσομοίωση της δυναμικής των πρωτεϊνών.
Το 2017 είχε μόλις ολοκληρώσει το διδακτορικό του όταν άκουσε φήμες ότι η Google DeepMind είχε αρχίσει, με μεγάλη μυστικότητα, να προβλέπει τις πρωτεϊνικές δομές. Τους έστειλε αίτηση για δουλειά, υποδεικνύοντας πως η εμπειρία του στην προσομοίωση πρωτεϊνών υποσχόταν δημιουργικές ιδέες για το πώς να βελτιώσει το AlphaFold. Ο Jumper και ο Hassabis καθοδήγησαν τελικά μαζί το έργο που αναμόρφωσε θεμελιωδώς το μοντέλο AI.
Η νέα έκδοση - AlphaFold2 - χρωματίστηκε από τις γνώσεις του Jumper για τις πρωτεΐνες. Η ομάδα άρχισε επίσης να χρησιμοποιεί την καινοτομία πίσω από την πρόσφατη τεράστια ανακάλυψη στην τεχνητή νοημοσύνη: νευρωνικά δίκτυα μετασχηματιστών. Αυτά μπορούν να βρουν μοτίβα σε τεράστιες ποσότητες δεδομένων με πιο ευέλικτο τρόπο από ό,τι προηγουμένως, και να καθορίσουν αποτελεσματικά την επίτευξη ενός συγκεκριμένου στόχου.
Η ομάδα εκπαίδευσε το AlphaFold2 στις τεράστιες πληροφορίες των βάσεων δεδομένων όλων των γνωστών πρωτεϊνικών δομών και αλληλουχιών αμινοξέων και η νέα αρχιτεκτονική AI άρχισε να προσφέρει καλά αποτελέσματα κυρίως πριν τον 14ο τέταρτο διαγωνισμό CASP.
Το 2020, όταν οι διοργανωτές του CASP αξιολόγησαν τα αποτελέσματα, κατάλαβαν ότι η 50χρονη μεγαλύτερη πρόκληση της βιοχημείας είχε τελειώσει. Στις περισσότερες περιπτώσεις, το AlphaFold2 έκανε σχεδόν εξίσου καλά κρυσταλλογραφία ακτίνων Χ, η οποία ήταν εκπληκτική.
Ένα εγχειρίδιο για τα κύτταρα άλλαξε τη ζωή του David Baker
Όταν ο David Baker ξεκίνησε να σπουδάζει στο Πανεπιστήμιο του Χάρβαρντ, επέλεξε τη φιλοσοφία και τις κοινωνικές επιστήμες. Ωστόσο, κατά τη διάρκεια ενός μαθήματος στην εξελικτική βιολογία έπεσε στα χέρια του η πρώτη έκδοση του κλασικού πλέον εγχειριδίου Molecular Biology of the Cell που τον έκανε να αλλάξει ρότα στη ζωή του. Άρχισε να εξερευνά την κυτταρική βιολογία και τελικά γοητεύτηκε από τις πρωτεϊνικές δομές. Όταν, το 1993, ξεκίνησε ως επικεφαλής της ομάδας στο Πανεπιστήμιο της Ουάσιγκτον στο Σιάτλ, πήρε μέρος στη μεγάλη πρόκληση της βιοχημείας. Χρησιμοποιώντας έξυπνα πειράματα, άρχισε να εξερευνά πώς αναδιπλώνονται οι πρωτεΐνες. Αυτό του έδωσε ιδέες για να αναπτύξει στα τέλη της δεκαετίας του 1990, ένα λογισμικό που μπορούσε να προβλέψει τις πρωτεϊνικές δομές: τη Rosetta.
Ο Baker έκανε το ντεμπούτο του στο διαγωνισμό CASP το 1998 χρησιμοποιώντας τη Rosetta και, σε σύγκριση με άλλους συμμετέχοντες, τα πήγε πολύ καλά. Αυτή η επιτυχία οδήγησε σε μια νέα ιδέα, να χρησιμοποιήσει το λογισμικό αντίστροφα. Αντί οι επιστήμονες να εισάγουν αλληλουχίες αμινοξέων στη Ροζέτα και να βγάλουν τις πρωτεϊνικές δομές, θα πρέπει να μπορούν να εισέλθουν σε μια επιθυμητή δομή πρωτεΐνης και να λάβουν προτάσεις για την αλληλουχία αμινοξέων της, η οποία θα τους επέτρεπε να δημιουργήσουν εντελώς νέες πρωτεΐνες.
Ο τομέας του σχεδιασμού πρωτεϊνών - όπου οι ερευνητές δημιουργούν κατά παραγγελία πρωτεΐνες με νέες λειτουργίες - άρχισε να απογειώνεται στα τέλη της δεκαετίας του 1990. Σε πολλές περιπτώσεις, οι ερευνητές τροποποιούσαν τις υπάρχουσες πρωτεΐνες για να κάνουν πράγματα όπως διάσπαση επικίνδυνων ουσιών ή χημική παραγωγή.
Ωστόσο, το φάσμα των φυσικών πρωτεϊνών ήταν περιορισμένο. Για να αυξήσει τη δυνατότητα απόκτησης πρωτεϊνών με εντελώς νέες λειτουργίες, η ερευνητική ομάδα του Baker ήθελε να τις δημιουργήσει από την αρχή.
Μια μοναδική πρωτεΐνη βλέπει το φως της δημοσιότητας
Το πεδίο στο οποίο κατασκευάζονται εντελώς νέες πρωτεΐνες ονομάζεται de novo design. Η ερευνητική ομάδα του Baker σχεδίασε μια πρωτεΐνη με μια εντελώς νέα δομή και στη συνέχεια έβαλε τη Rosetta να υπολογίσει την αλληλουχία των αμινοξέων που θα μπορούσε να οδηγήσει στην επιθυμητή πρωτεΐνη. Για να το κάνει αυτό, η Rosetta έψαξε σε μια βάση δεδομένων όλων των γνωστών πρωτεϊνικών δομών και αναζήτησε μικρά θραύσματα πρωτεϊνών που είχαν ομοιότητες με την επιθυμητή δομή. Χρησιμοποιώντας θεμελιώδεις γνώσεις για το ενεργειακό τοπίο των πρωτεϊνών, η Rosetta βελτιστοποίησε αυτά τα θραύσματα και πρότεινε μια αλληλουχία αμινοξέων.
Για να διερευνήσει πόσο επιτυχημένο ήταν το λογισμικό, η ερευνητική ομάδα του Baker εισήγαγε το γονίδιο για την προτεινόμενη αλληλουχία αμινοξέων σε βακτήρια τα οποία παρήγαν την επιθυμητή πρωτεΐνη. Στη συνέχεια προσδιόρισε την δομή της πρωτεΐνης χρησιμοποιώντας κρυσταλλογραφία ακτίνων Χ και αποδείχθηκε ότι η Rosetta μπορούσε πραγματικά να κατασκευάσει πρωτεΐνες.
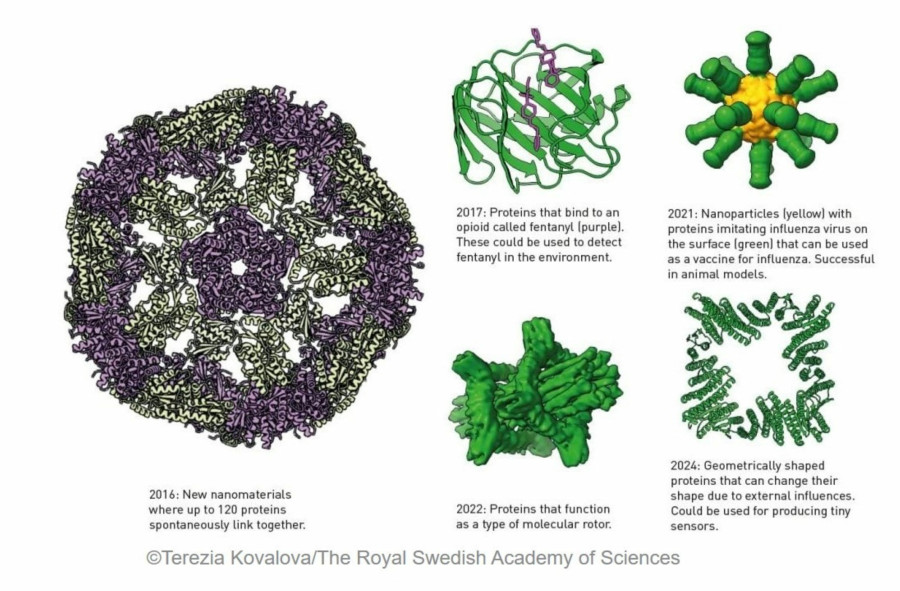
Η τεχνητή πρωτεΐνη που ανέπτυξαν οι ερευνητές, η Top7, είχε σχεδόν ακριβώς την δομή που είχαν σχεδιάσει. Όσοι είχαν δημιουργήσει προηγουμένως de novo πρωτεΐνες είχαν μόνο την δυνατότητα να μιμηθούν τις υπάρχουσες δομές. Η μοναδική δομή της Top7 δεν υπήρχε στη φύση. Επίσης, με τα 93 αμινοξέα της, η πρωτεΐνη ήταν μεγαλύτερη από οτιδήποτε είχε παραχθεί προηγουμένως χρησιμοποιώντας de novo σχεδιασμό.
Ο Baker δημοσίευσε την ανακάλυψή του το 2003. Επίσης κυκλοφόρησε τον κώδικα για την Rosetta, έτσι μια παγκόσμια ερευνητική κοινότητα συνέχισε να αναπτύσσει το λογισμικό, βρίσκοντας νέους τομείς εφαρμογής.
Η εργασία που κάποτε χρειαζόταν χρόνια τώρα διαρκεί μόνο λίγα λεπτά
Όταν ο Demis Hassabis και ο John Jumper επιβεβαίωσαν ότι το AlphaFold2 λειτούργησε πραγματικά, υπολόγισαν την δομή όλων των ανθρώπινων πρωτεϊνών. Στη συνέχεια, προέβλεψαν την δομή σχεδόν και των 200 εκατομμυρίων πρωτεϊνών που έχουν ανακαλύψει μέχρι στιγμής οι ερευνητές κατά τη χαρτογράφηση των οργανισμών της Γης.
Το Google DeepMind έχει επίσης διαθέσει τον κώδικα για το AlphaFold2 και ο καθένας μπορεί να έχει πρόσβαση σε αυτόν. Το μοντέλο AI αποτελεί ‘χρυσωρυχείο’ για τους ερευνητές. Μέχρι τον Οκτώβριο του 2024, το AlphaFold2 είχε χρησιμοποιηθεί από περισσότερα από δύο εκατομμύρια άτομα από 190 χώρες. Προηγουμένως, συχνά χρειάζονταν χρόνια για να αποκτηθεί μια δομή πρωτεΐνης, αν και καθόλου. Τώρα μπορεί να γίνει σε λίγα λεπτά.
Μετά τον διαγωνισμό CASP του 2020, όταν ο David Baker συνειδητοποίησε τις δυνατότητες των μοντέλων τεχνητής νοημοσύνης που βασίζονται σε μετασχηματιστές μηχανικής μάθησης, πρόσθεσε ένα στη Rosetta, η οποία διευκόλυνε επίσης τον de novo σχεδιασμό των πρωτεϊνών. Τα τελευταία χρόνια, η μια πρωτεΐνη μετά την άλλη αναδύεται από το εργαστήριο του Baker.
Η εκπληκτική ευελιξία των πρωτεϊνών ως χημικών εργαλείων αντανακλάται στην τεράστια ποικιλία της ζωής. Το ότι μπορούμε τώρα τόσο εύκολα να οραματιστούμε την δομή αυτών των μικρών μοριακών μηχανών είναι συγκλονιστικό. Μας επιτρέπει να κατανοήσουμε καλύτερα πώς λειτουργεί η ζωή, συμπεριλαμβανομένου του γιατί αναπτύσσονται ορισμένες ασθένειες, πώς εμφανίζεται η αντίσταση στα αντιβιοτικά ή γιατί ορισμένα μικρόβια μπορούν να αποσυνθέσουν το πλαστικό.
Η ικανότητα δημιουργίας πρωτεϊνών που είναι φορτωμένες με νέες λειτουργίες είναι εξίσου εκπληκτική. Αυτό μπορεί να οδηγήσει σε νέα νανοϋλικά, σε στοχευμένα φαρμακευτικά προϊόντα, σε πιο γρήγορη ανάπτυξη εμβολίων, σε μικροσκοπικούς αισθητήρες και σε μια πιο πράσινη χημική βιομηχανία, για να αναφέρουμε μόνο μερικές εφαρμογές που είναι προς το μέγιστο όφελος της ανθρωπότητας.
Πηγή:Nobelprize.org
























